Среди множества химических элементов из Периодической системы Д.И. Менделеева представителя под номером 6 можно по праву считать «царственным». Углерод образует миллионы органических и неорганических соединений. Причина многообразия заключается в уникальности строения его атомов. Для него свойственно явление аллотропии. Такие разные вещества алмаз, графит и другие – это все углерод.
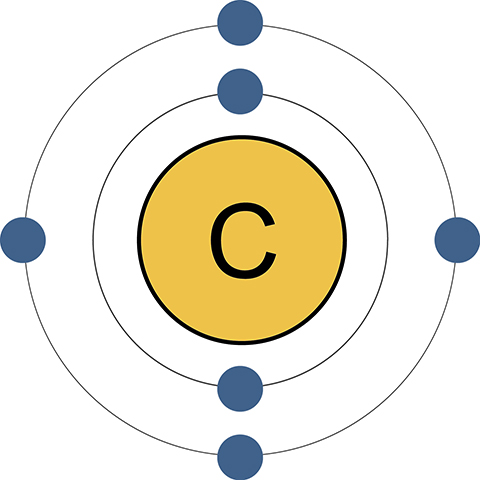
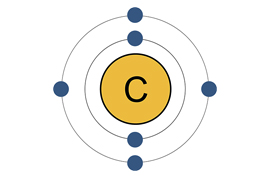
Строение атома
На внешней энергетической оболочке находятся 4 электрона, ближе к ядру – еще 2. Полностью заполненной считается «заветная восьмерка». Имеющаяся ровно половина от нее дает возможность атому как принимать дополнительные электроны на вакантные места, так и отдавать. Таким образом, углерод обладает самым широким диапазоном электронных переходов.
Его сосед по главной подгруппе кремний имеет столько же крайних отрицательно заряженных частиц в ядре. Но у последнего элемента гораздо больше общее количество электронов (14), что осложняет их прием и передачу. Так, в молекуле углекислого газа СО2 углерод отдает все 4 крайних электрона более электроотрицательному элементу – кислороду. А в метане СН4 принимает столько же от водорода.
Волшебная аллотропия
Причина фантастического явления заключается в разном строении кристаллических решеток. Углерод имеет атомную, но ее подвиды удивляют:
- У алмаза в виде тетраэдра.
- Графита – плоская.
- Карбина – линейная.
- Фуллерена – экзотическая.
Атомы углерода в кристаллической решетке вещества графита лежат в одной плоскости. Они прочно связаны, образуют шестиугольники. Между их слоями связи слабые – след от карандаша остается на бумаге. А вот температуру графит выдерживает высокую. Из него изготовляют углероды, замедлители нейронов (ядерных частиц) в реакторах, твердые смазки.

Алмазы и их истории
Известное с древности вещество получило название «твердейший» – «алмас» (на арабском языке), «несокрушимый» – «адамас» (греческом). Алмазы имеют персональную единицу измерения массы: 1 карат равен 0,2 г. Прозрачные камни ограняют, бриллиантами украшают изделия.
У крупных алмазов зачастую детективные истории. В российском фонде содержатся 7 исторических камней. Так, экземпляр «Шах» (87 каратов) был найден в 16 веке. Он хранился у индийских вельмож, потом оказался у монголов и менял еще не раз своих хозяев. В 1739 году попал в Персию. Через 90 лет персидские власти им пытались откупиться за убийство русского дипломата-поэта А.С. Грибоедова.

Полезная адсорбция
Древесный уголь и сажа – это тоже углерод. Первый получают в результате сухой перегонки древесины. Благодаря своей пористой поверхности, уголь имеет способность поглощать растворенные вещества и газы. Эффективность адсорбции зависит от его пористости.
Технически поглотительную способность увеличивают, обрабатывая уголь водяным горячим паром. Полученный образец называется активированным. Реализуется карболен через аптечную сеть. Помогает лекарственное средство при диспепсических симптомах (тошноте, рвоте, поносе), отравлении, интоксикации организма.
Угарный, углекислый газы и другие соединения
С кислородом углерод образует оксиды, с металлами – карбиды. Куски серого цвета (соединение с кальцием) газосварщики применяют с целью получения ацетилена. Газы-оксиды углерода бесцветные и не имеют запаха. Но на этом их общие свойства ограничиваются. Угарный – малорастворим в воде. Он очень ядовитый.
На основе углекислого газа производят «сухой лед» для хранения пищевых продуктов. Данное соединение углерода не поддерживает горение. Применяется для тушения очагов возгорания. Используют углекислый газ для создания пищевой соды, шипучих напитков (лимонада, шампанского).
Противогаз на углероде
Действие противогазов основано на адсорбции активированного угля, Устройство защищает человека от опасных примесей, имеющихся в воздухе. Впервые противогазы, изобретенные русским химиком Н.Д. Зелинским, использовались во время первой мировой войны.
Углерод в природе
«Карбонеум», так звучит название химического элемента по латыни. Главным карбонатным минералом считается кальцит. Природный формат его: мел, мрамор, известняк. Углекислый газ содержится в выдыхаемом живыми организмами воздухе. Вблизи фабрик, заводов, транспортных магистралей концентрация его больше. Образуется оксид при гниении, горении, тлении органических веществ.
Дословный перевод элемента на русский язык – «рождающий уголь». В соленых водах океанов и морей оксида углерода-4 больше, чем в воздухе. До 99% элемента содержится в каменном угле, 72% – буром, 57% – торфе. Нефть – это смесь водородных соединений углерода, находящихся в разных агрегатных состояниях (жидком, газообразном, твердом). Все источники участвуют в круговороте элемента в природе. Углерод является основой живой природы.
Жесткая вода
Соли угольной кислоты обуславливают жесткость воды. Такая жидкость неудобна в употреблении. Она оставляет следы белого цвета на одежде, мебели, накипь на посуде. Жесткая вода не промывает волосы и плохо мылится. В ней дольше развариваются овощи, мясо, крупы, бобовые. Чтобы сделать ее мягкой следует добавлять техническую соду, кипятить.

Другие факты об углероде
- При высоких давлении и температуре из графита производят искусственные алмазы, их применяют в технических целях (стеклорезы, сверла).
- Самое большое количество углекислого газа поступает в атмосферу в результате извержения вулканов.
- В истории Земли выделяют целый период в Палеозойской эре, который носит название карбона или каменноугольного. Именно в то время появились первые крылатые насекомые, акулы, пресмыкающиеся.
- Главной составной частью природного газа являются углеводороды.
- Раствор углекислого газа окрашивает лакмусовую бумажку (индикатор) в красный цвет. При стоянии новая проверка приводит к тому, что лакмус возвращает себе прежнюю фиолетовую окраску.
- Понятие «карат» появилось в древности. Так называли косточку аравийского дерева, имеющую точный вес. Природные «гирьки» использовали ювелиры при взвешивании изделий.
- Натуральный алмаз горит ослепительным пламенем. Единственным продуктом реакции является углекислый газ.
- Противоядие при отравлении угарным газом – это вдыхание чистого кислорода, свежего воздуха.










